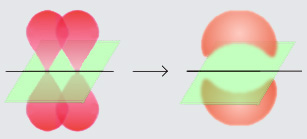
Liaisons Pi Et Sigma. La liaison sigma est une liaison entre atomes dans une molécule qui se forme souvent par s orbitales se chevauchant le long de laxe reliant les noyaux jointsIl est le premier à se former et sa stabilité dépend de la distribution des électrons dans les orbitales sigma et antilondantesLes liaisons pi sont des liaisons moléculaires formées souvent à partir. Chaque carbone est lié à deux hydrogènes et deux fois à lautre carbone. About Press Copyright Contact us Creators Advertise Developers Terms Privacy Policy Safety How YouTube works Test new features Press Copyright Contact us Creators. IP archivée la primate humaine esthetiquement la mieux reussie nest jamais plus quun aquarium ambulant empli dune mer interieure et peuplée de cellules vivantes.
La double liaison et la combinaison entre une liaison pi et une liaison sigma elle est donc plus forte quune simple liaison sigma. La liaison σ prononcée sigma est une liaison chimique covalente créée entre deux atomes par recouvrement axial dorbitales. Car il y a 2 structures de résonance et la liaison est simple dans une et double dans lautre. Une liaison delta est une liaison chimique covalente où 4 lobes dune orbitale occupée par un seul électron se recouvrent avec 4 lobes dune autre orbitale occupée par un seul électronIl y a exactement deux plans nodaux entre les deux atomes liés. Les liaisons pi se forment également à partir dorbitales atomiques orientées perpendiculairement à celles qui forment les liaisons sigma. Chaque carbone est lié à deux hydrogènes et deux fois à lautre carbone.
Legătură sigma Legătură pi Legătură delta Legătură phi Legătură simplă Legătură dublă Legătură triplă Legătură coordinativă Legătură disulfurică.
Chaque carbone est lié à deux hydrogènes et deux fois à lautre carbone. Il y a trois liaisons sigma σ et une pi π dans cette molécule Lhybridation de chaque atome de carbone sera sp². Les liaisons sigma et les liaisons pi sont toutes deux basées sur des orbitales moléculaires spécifiques dérivées du chevauchement dorbitales atomiques particulières par exemple s orbitales dans le cas de liaisons sigma et p orbitales dans le cas de liaisons pi. Forțe van der Waals. Il peut sagir dorbitales de type s ou s hybridées mais aussi dorbitales p z et d z² laxe z étant laxe de la liaison. Ces liens se forment par chevauchement de liens incomplets s et p orbitales de deux atomes qui participent à la liaison.
